Humant beta-amyloid (1-42) protein, også kjent som Aβ 1-42, er en nøkkelfaktor for å låse opp mysteriene til Alzheimers sykdom.Dette peptidet spiller en sentral rolle i dannelsen av amyloide plakk, gåtefulle klynger som skader hjernen til Alzheimers pasienter.Med en destruktiv effekt forstyrrer den nevronal kommunikasjon, utløser betennelse og induserer nevrotoksisitet, noe som fører til kognitiv svekkelse og nevrale skader.Å undersøke dens aggregerings- og toksisitetsmekanismer er ikke bare viktig;det er en spennende reise mot å løse Alzheimers puslespill og utvikle fremtidige terapier.



Aβ 1-42 er et peptidfragment på 42 aminosyrer som er avledet fra spaltningen av amyloid-forløperproteinet (APP) av β- og γ-sekretaser.Aβ 1-42 er en av hovedkomponentene i amyloidplakkene som akkumuleres i hjernen til pasienter med Alzheimers sykdom, en nevrodegenerativ lidelse preget av kognitiv svikt og hukommelsestap.Aβ 1-42 har vist seg å ha forskjellige funksjoner og anvendelser innen biologisk og biomedisinsk forskning, som:
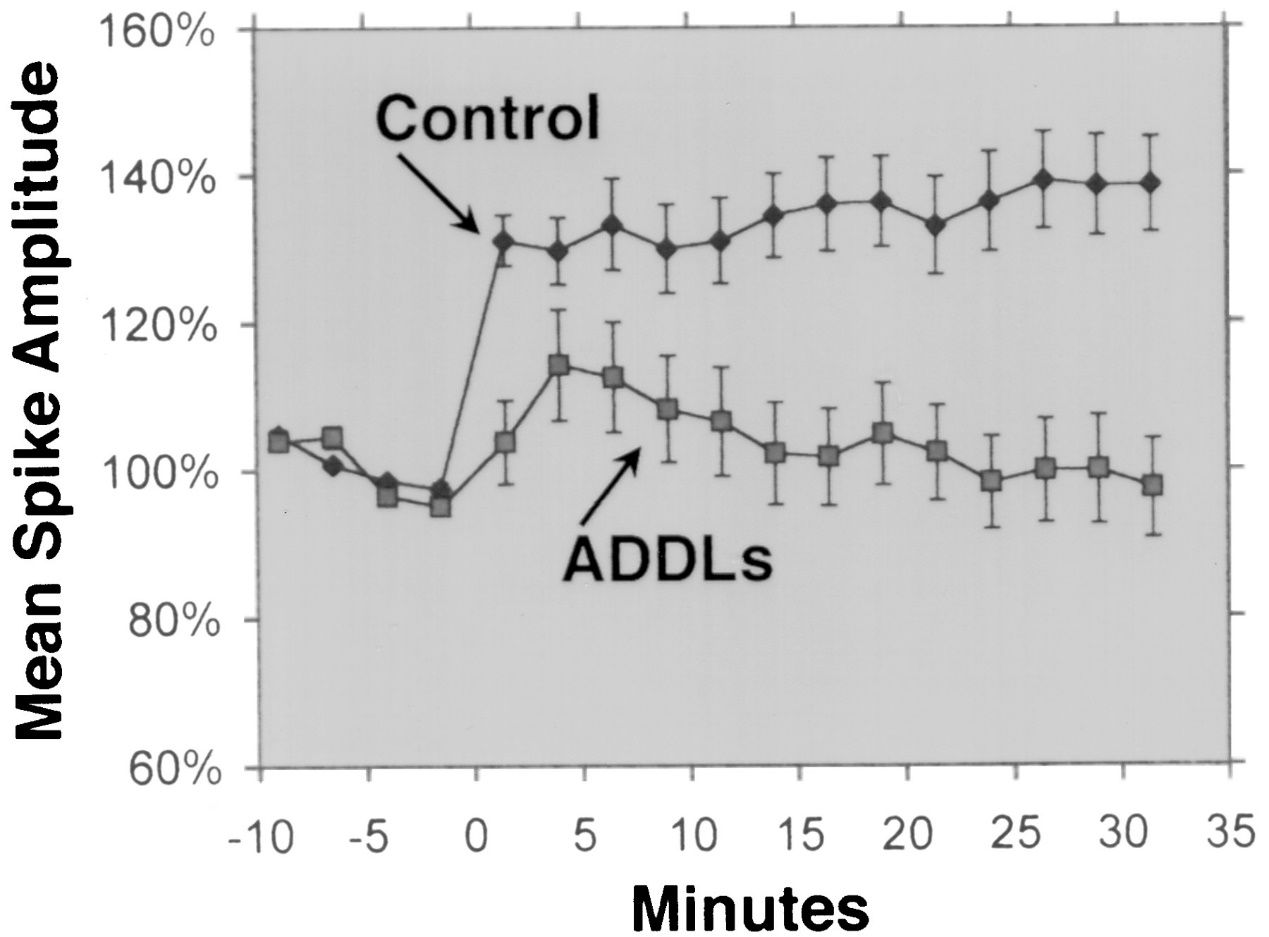
1. Nevrotoksisitet: Aβ 1-42 kan danne løselige oligomerer som er i stand til å binde seg til og forstyrre funksjonen til nevronale membraner, reseptorer og synapser.Disse oligomerene kan også indusere oksidativt stress, betennelse og apoptose i nevroner, noe som fører til synaptisk tap og nevronal død.Aβ 1-42-oligomerer anses å være mer nevrotoksiske enn andre former for Aβ, slik som Aβ 1-40, som er den mest utbredte formen av Aβ i hjernen.Aβ 1-42-oligomerer antas også å kunne forplante seg fra celle til celle, i likhet med prioner, og utløse feilfolding og aggregering av andre proteiner, slik som tau, som danner nevrofibrillære floker ved Alzheimers sykdom.
Aβ 1-42 er allment ansett som den Aβ-isoformen med høyest nevrotoksisitet.Flere eksperimentelle studier har vist nevrotoksisiteten til Aβ 1-42 ved bruk av forskjellige metoder og modeller.For eksempel, Lesné et al.(Brain, 2013) undersøkte dannelsen og toksisiteten til Aβ-oligomerer, som er løselige aggregater av Aβ-monomerer, og viste at Aβ 1-42-oligomerer hadde en sterkere skadelig effekt på neuronale synapser, noe som førte til kognitiv nedgang og neuronalt tap.Lambert et al.(Proceedings of the National Academy of Sciences, 1998) fremhevet nevrotoksisiteten til Aβ 1-42-oligomerer og fant at de hadde en sterk toksisk effekt på sentralnervesystemet, muligens ved å påvirke synapser og nevrotransmittere.Walsh et al.(Nature, 2002) viste den hemmende effekten av Aβ 1-42-oligomerer på hippocampus langsiktig potensering (LTP) in vivo, som er en cellulær mekanisme som ligger til grunn for læring og hukommelse.Denne hemmingen var assosiert med hukommelse og læringssvikt, og understreket virkningen av Aβ 1-42-oligomerer på synaptisk plastisitet.Shankar et al.(Nature Medicine, 2008) isolerte Aβ 1-42 dimerer direkte fra Alzheimers hjerner og viste deres effekt på synaptisk plastisitet og hukommelse, og ga empiriske bevis for nevrotoksisiteten til Aβ 1-42 oligomerer.
I tillegg har Su et al.(Molecular & Cellular Toxicology, 2019) utførte transkriptomikk og proteomikkanalyse av Aβ 1-42-indusert nevrotoksisitet i SH-SY5Y-nevroblastomceller.De identifiserte flere gener og proteiner som ble påvirket av Aβ 1-42 i veier relatert til apoptotisk prosess, proteintranslasjon, cAMP katabolsk prosess og respons på endoplasmatisk retikulumstress.Takeda et al.(Biological Trace Element Research, 2020) undersøkte rollen til ekstracellulær Zn2+ i Aβ 1-42-indusert nevrotoksisitet ved Alzheimers sykdom.De viste at Aβ 1-42-indusert intracellulær Zn2+ toksisitet ble akselerert med aldring på grunn av aldersrelatert økning i ekstracellulær Zn2+.De antydet at Aβ 1-42 utskilt kontinuerlig fra nevronterminaler forårsaker aldersrelatert kognitiv nedgang og nevrodegenerasjon via intracellulær Zn2+ dysregulering.Disse studiene antyder at Aβ 1-42 er en nøkkelfaktor for å mediere nevrotoksisitet og sykdomsprogresjon ved Alzheimers sykdom ved å påvirke ulike molekylære og cellulære prosesser i hjernen.
2. Antimikrobiell aktivitet: Aβ 1-42 har blitt rapportert å ha antimikrobiell aktivitet mot forskjellige patogener, som bakterier, sopp og virus.Aβ 1-42 kan binde seg til og forstyrre membranene til mikrobielle celler, noe som fører til lysis og død.Aβ 1-42 kan også aktivere det medfødte immunsystemet og rekruttere inflammatoriske celler til infeksjonsstedet.Noen studier har antydet at akkumulering av Aβ i hjernen kan være en beskyttende respons på kroniske infeksjoner eller skader.Imidlertid kan overdreven eller dysregulert produksjon av Aβ også forårsake sideskade på vertscellene og vevet.
Aβ 1-42 har blitt rapportert å vise antimikrobiell aktivitet mot en rekke patogener, som bakterier, sopp og virus, som Staphylococcus aureus, Escherichia coli, Candida albicans og Herpes simplex virus type 1, ved å samhandle med deres membraner og forårsaker avbrudd og lysis.Kumar et al.(Journal of Alzheimer's Disease, 2016) demonstrerte denne effekten ved å vise at Aβ 1-42 endret membranpermeabiliteten og morfologien til mikrobielle celler, noe som førte til deres død.I tillegg til sin direkte antimikrobielle virkning, kan Aβ 1-42 også modulere den medfødte immunresponsen og rekruttere inflammatoriske celler til infeksjonsstedet.Soscia et al.(PLoS One, 2010) avslørte denne rollen ved å rapportere at Aβ 1-42 stimulerte produksjonen av pro-inflammatoriske cytokiner og kjemokiner, slik som interleukin-6 (IL-6), tumornekrosefaktor-alfa (TNF-α), monocytt kjemoattraktant protein-1 (MCP-1), og makrofag inflammatorisk protein-1 alfa (MIP-1α), i mikroglia og astrocytter, de viktigste immuncellene i hjernen.
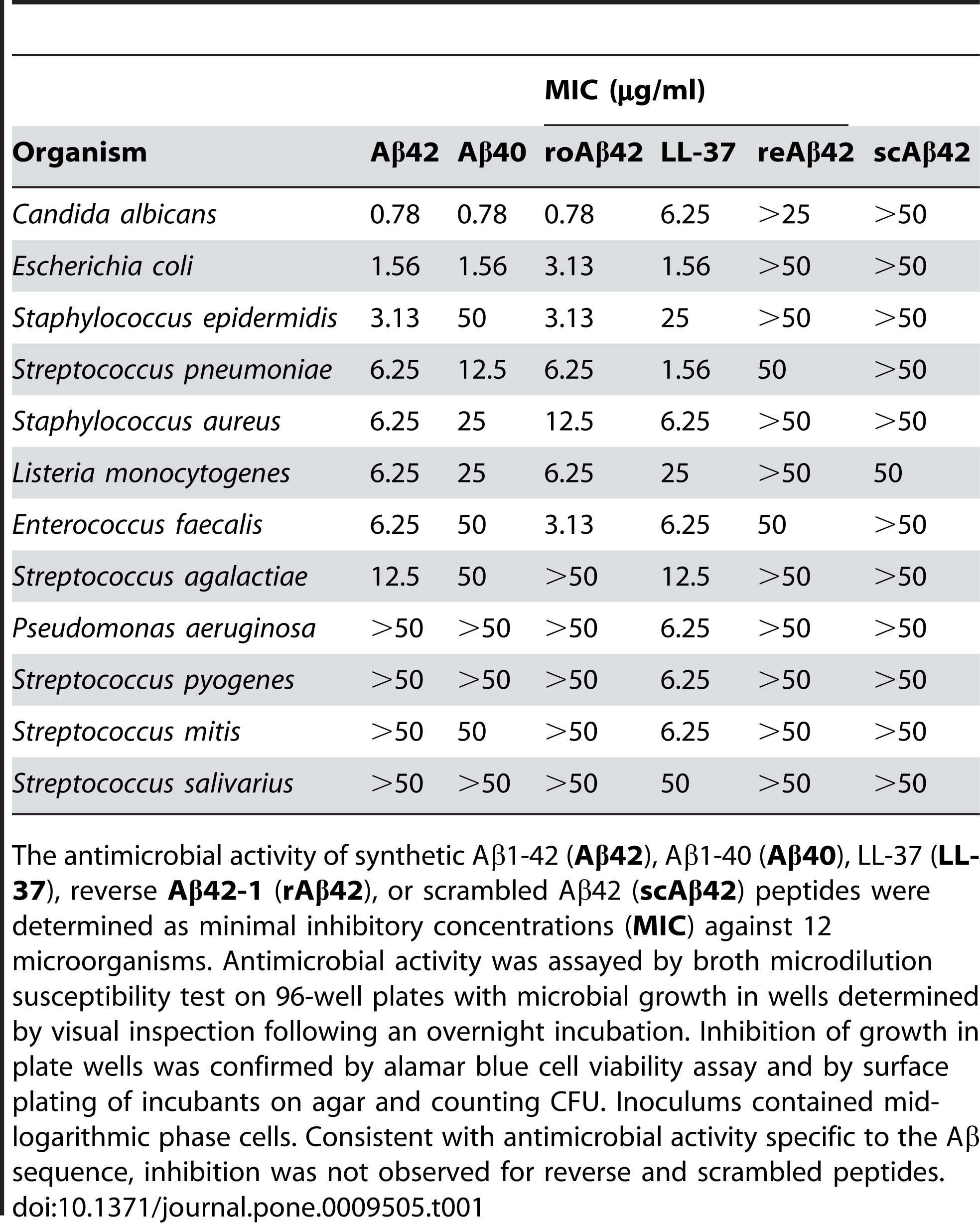
Figur 2. Aβ-peptider har antimikrobiell aktivitet.
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. Alzheimers sykdom assosiert amyloid beta-protein er et antimikrobielt peptid. PLoS One . 3. mars 2010;5(3):e9505.)
Mens noen studier har antydet at akkumulering av Aβ i hjernen kan være en beskyttende respons på kroniske infeksjoner eller skader, ettersom Aβ kan fungere som et antimikrobielt peptid (AMP) og eliminere potensielle patogener, forblir det komplekse samspillet mellom Aβ og mikrobielle elementer en etterforskningstema.Den delikate balansen fremheves av forskningen til Moir et al.(Journal of Alzheimer's Disease, 2018), som antyder at ubalansert eller overdreven Aβ-produksjon utilsiktet kan skade vertsceller og vev, noe som gjenspeiler den intrikate doble naturen til Aβs roller i infeksjon og nevrodegenerasjon.Overdreven eller dysregulert produksjon av Aβ kan føre til dens aggregering og avsetning i hjernen, og danner giftige oligomerer og fibriller som svekker nevronal funksjon og induserer nevroinflammasjon.Disse patologiske prosessene er assosiert med kognitiv nedgang og hukommelsestap ved Alzheimers sykdom, en nevrodegenerativ lidelse preget av progressiv demens.Derfor er balansen mellom de gunstige og skadelige effektene av Aβ avgjørende for å opprettholde hjernens helse og forhindre nevrodegenerasjon.
3. Jerneksport: Aβ 1-42 har vist seg å være involvert i reguleringen av jernhomeostase i hjernen.Jern er et essensielt element for mange biologiske prosesser, men overflødig jern kan også forårsake oksidativt stress og nevrodegenerasjon.Aβ 1-42 kan binde seg til jern og lette eksporten fra nevroner via ferroportin, en transmembran jerntransportør.Dette kan bidra til å forhindre jernakkumulering og toksisitet i hjernen, da overflødig jern kan forårsake oksidativt stress og nevrodegenerasjon.Duce et al.(Cell, 2010) rapporterte at Aβ 1-42 bandt seg til ferroportin og økte dets uttrykk og aktivitet i nevroner, noe som førte til reduserte intracellulære jernnivåer.De viste også at Aβ 1-42 reduserte uttrykket av hepcidin, et hormon som hemmer ferroportin, i astrocytter, noe som ytterligere forbedret jerneksporten fra nevroner.Imidlertid kan jernbundet Aβ også bli mer utsatt for aggregering og avsetning i det ekstracellulære rommet, og danner amyloidplakk.Ayton et al.(Journal of Biological Chemistry, 2015) rapporterte at jern fremmet dannelsen av Aβ-oligomerer og fibriller in vitro og in vivo.De viste også at jernkelering reduserte Aβ-aggregering og avsetning hos transgene mus.Derfor er balansen mellom de gunstige og skadelige effektene av Aβ 1-42 på jernhomeostase avgjørende for å opprettholde hjernens helse og forhindre nevrodegenerasjon.
Vi er en polypeptidprodusent i Kina, med flere års moden erfaring innen polypeptidproduksjon.Hangzhou Taijia Biotech Co., Ltd. er en profesjonell produsent av polypeptidråvarer, som kan tilby titusenvis av polypeptidråvarer og kan også tilpasses etter behov.Kvaliteten på polypeptidprodukter er utmerket, og renheten kan nå 98 %, noe som har blitt anerkjent av brukere over hele verden. Velkommen til å konsultere oss.






